Zhang Xinbo, Yu Jing, Tian Jianniao, Bian He Dong, Liang Hong
(Key Laboratory for Chemistry and Molecular Engineering of Medicinal Resources, Ministry of Education of China, Guangxi Normal University, 541004, Guilin)
Project supported by the National Natural Science Foundation of China (20671023), the Natural Science Foundation of Guangxi and Key Laboratory for Chemistry and Molecular Engineering of Medicinal Resources.
AbstractThe conformational changes of bovine serum albumin (BSA) have been studied by Circular dichroism (CD) and Fourier transform infrared (FT-IR) spectroscopy under extremely low frequency pulsing electromagnetic fields (ELF-PEMF). FT-IR spectrum of BSA showed that the maximum amide I of BSA shift from 1650.63 to 1646.36, 1644.26 cm-1, and the maximum amide IIof BSA moved from 1549.57 to 1547.85, 1547.39 cm-1 after irradiation 30 and 60 min of ELF-PEMF, respectively. Curve-fitted amide I(1700-1600) regions and CD spectra showed that theαhelix of BSA decreased and protein secondary structure has been changed because of the effect of ELF-PEMF.
Keywords BSA; ELF-PEMF; CD spectra; FT-IR spectra
超低频脉冲电磁场作用下牛血清白蛋白的构象研究
张新波 余静 田建 边贺东 梁宏*
(药用资源化学与药物分子工程教育部重点实验室,广西师范大学,541004,桂林)
国家自然科学基金(20671023),广西自然科学基金,药用资源化学与药物分子工程教育部重点实验室资助项目。
摘要 应用傅立叶红外(FT-IR)和园二色光谱法(CD)研究了在生理pH条件下牛血清白蛋白(BSA)在超低频脉冲电场作用下的构像变化。傅立叶红外光谱显示,牛血清白蛋白经超低频脉冲电磁场作用30和60 min后酰胺I带的最大吸收峰从1650.63 移到了1646.36、1644.26 cm-1,而酰胺II带的最大吸收峰却从1549.57 移到了1547.85、1547.39 cm-1;红外曲线拟合以及圆二色光谱结果表明经低频脉冲电场作用下BSA的-螺旋结构的含量降低,其二级结构发生了改变。
关键词 牛血清白蛋白(BSA);超低频脉冲电场;园二色光谱(CD);傅立叶红外光谱(FT-IR)
1 引言
极低频电磁场(ELF-EMF) 指频率在0~ 100 Hz(美国) 或30~ 300 Hz (欧洲) 的电磁场, 按其波长和能量范围, 属非电离辐射[1]。作为现代科技革命重要组成部分的电磁技术革命,对人类社会的发展起来非常重要的作用,也带来了有关电磁卫生等一系列问题,有关低频电磁场对人体或生物的潜在性健康效应, 已成为一个人们普遍关注的课题,近年来对极低频磁场生物效应的研究逐渐增多,但是对血清蛋白构象的变化方面研究的报道还相对较少。血清白蛋白是血浆中含量最丰富的载体蛋白质, 它能与许多内源及外源性化合物结合, 起到存储与转运的作用。研究低频脉冲电磁场对血清白蛋白之间的作用, 有助于了解低频脉冲电磁场对于人体的影响, 对于研究电磁卫生有非常重要的意义。本文利用傅立叶红外光谱和园二色光谱测定了牛血清白蛋白(BSA)在超低频脉冲电磁场作用下的构象的变化。
2 实验部分
2.1 仪器与试剂
Perkin Elmer instruments Spectrum One 红外分光光度计,Jasco-810 园二色光谱仪(日本,Jasco 公司),Phy-Ⅲ超低频脉冲磁场发生仪(第四军医大学);牛血清白蛋白(电泳纯,分子量为66210,购自Sigma 公司),BSA溶液用前新鲜配制,其浓度用光度法测定,按278 nm 处1 mg·L-1 BSA在1 cm 光程时吸光度为0.667计算。所有溶液配制均用二次去离子水(电导率小于1),均含0.15 mol·L-1 NaCl 以保持相同的离子强度,并用 0.1 mol·L-1 磷酸缓冲溶液保持pH = 7.43(±0.02)。
2.2 实验方法
2.2.1 高纯水的制备
阴阳树脂按常规方法处理,取普通的一次蒸馏水依次通过阳离子、阴离子、混合型树脂,控制3滴/秒的滴速,到水的电导率达到要求为止[2]。
2.2.2 红外光谱的测定
用Perkin Elmer instruments Spectrum One红外分光光度计测定红外光谱,扫描的试样分别为PBS缓冲溶液的吸收光谱、BSA (1×10-3 mol·L-1)吸收光谱(图中扣除了缓冲液的吸收)、BSA在脉冲电磁场下分别作用30 ,60 min 的 BSA 溶液吸收光谱(图中扣除了缓冲液的吸收)。
2.2.3 园二色光谱的测定
配制4.0×10-6mol·L-1 BSA溶液,取用5ml BSA三份,在电磁场中作用的时间分别为0 、30 、60 min ; 用Jasco-810圆二色光谱仪测定其波长200-350 nm范围内的圆二色光谱,样品池为1 mm 石英吸收皿。光谱扣除了PBS缓冲溶液的干扰。
3. 结果与讨论
3.1 红外光谱

图1 超低频脉冲电磁场作用前后BSA的傅立叶红外差谱
a 为作用前的BSA; b 为作用30 min 的BSA; c 为作用60 min 的BSA;
[BSA] = 1×10-3 mol·L-1,T = 298 K, PBS 缓冲溶液, pH = 7.43;
图为超低频脉冲电磁场作用前后BSA的傅立叶红外差谱。如图所示,(a)为BSA(5 × 10-4 mol·-1)吸收光谱;分别为超低频脉冲电磁场作用30 min和60 min后BSA的吸收光谱;图中都扣除了缓冲液的干扰。超低频脉冲电磁场作用30和60 min后,酰胺带的最大吸收峰从1650.63 cm-1分别移动到了1646.36和1644.26 cm-1;而酰胺II带的最大吸收峰却从1549.57 cm-1 移到了1547.85、1547.39 cm-1。结果表明,由于超低频脉冲电磁场对BSA的作用,使得BSA的二级结构发生了变化[3,4]。
蛋白质的红外光谱中,酰胺Ⅰ带对蛋白质分子二级结构变化比较敏感,所以,酰胺Ⅰ带的变化可近似地表征蛋白质分子二级结构的类型[5,6]。但在IR谱中酰胺Ⅰ带是不同二级结构谱的叠加,因此需用去卷积和通过曲线拟合进行谱带展开。当酰胺Ⅰ带在1695~1658 cm-1 时为-转角结构,当酰胺Ⅰ带在1658 – 1650 cm-1 时则为α-螺旋结构,当酰胺Ⅰ带在1650 – 1640 cm-1 时则为无规则卷曲结构,当酰胺Ⅰ带在1640 – 1610 cm-1 时为-折叠结构[7]。
根据红外曲线拟合结果(图2)得到BSA经过超低频脉冲磁场作用30和60 min后 BSA的各种构象的百分含量(表1),由表1所示,-折叠的成分由36.9%分别改变为36.9% 、40.7%,-转角构象由7.2%改变为16.9% 、15.6%,而-螺旋则由55.9% 减少到45.9%、43.7%,表明由于超低频脉冲电磁场对BSA的作用,使得BSA的二级结构发生了明显变化。

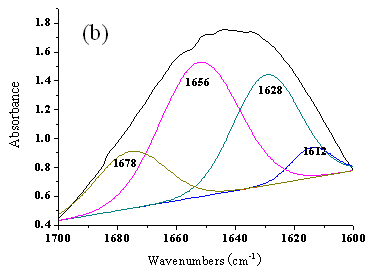
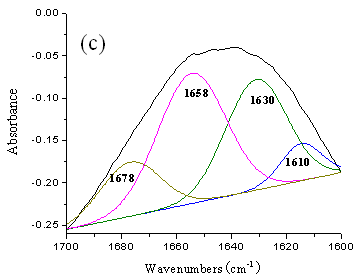
图2 超低频脉冲磁场作用后BSA的去卷积FT-IR酰胺Ⅰ带曲线拟合结果
(a) 作用前的BSA (b) 作用 30min 的BSA(c) 作用 60min 的BSA
T = 298K,PBS 缓冲溶液,pH = 7.43;
表1 超低频脉冲电磁场作用后BSA二级结构各构象的百分含量
| 作用时间(min) | -helix (%) | -sheet (%) | -turn (%) |
| 55.9 | 36.9 | 7.2 | |
| 30 | 45.9 | 37.2 | 16.9 |
| 60 | 43.7 | 40.7 | 15.6 |
3.2 园二色光谱
图2为超低频脉冲电磁场作用前后BSA的圆二色光谱。如图所示a为BSA(4×10-6mol·-1)的圆二色光谱图; b,c分别为超低频脉冲电磁场作用30,60 min 后 BSA的圆二色光谱图;图中均扣除了缓冲液和药物的干扰。从图中我们可以知道,BSA在208和220 nm处存在两个负槽[8],通过电磁场的作用后,负槽的强度变弱,但其CD谱的形状并未改变。此结果表明,在BSA中-螺旋结构占主导地位,电磁场作用改变了BSA的二级结构,使得-螺旋结构在二级结构中所占的含量减少。
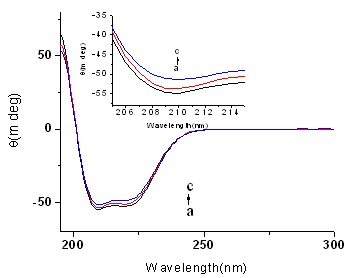
图3 超低频脉冲电磁场作用后BSA的园二色光谱(插图为208nm处负槽的CD光谱的放大图)
作用前的 BSA; b 作用30 min的BSA; c 作用 60 min 的BSA;
T = 298 K, PBS缓冲溶液, pH = 7.43, [BSA] = 4.0 × 10-6 mol·-1
蛋白质的-螺旋结构含量可通过计算求得:
MRE208obs( deg)/(10××L×C) (1)
其中 [MRE208为残基的椭圆率,obs椭圆度,为氨基酸的数目,L为样品池的直径,C为蛋白质的摩尔浓度。-螺旋结构含量可通过CD光谱在208 nm处的椭圆率求得[9]:
% helix=[([MRE208-4000)/(33000-4000)]×100 (2)
根据(1)、(2)式,我们求得 BSA 的-螺旋结构含量为54.18% ,超低频脉冲电磁场分别作用30,60min后,蛋白质的-螺旋结构含量分别下降到52.13%、48.76%。此结果表明了超低频脉冲电磁场的作用使得 BSA 的构象发生了变化,超低频脉冲电磁场对 BSA 的作用诱导了蛋白质多肽链的重排进而使得蛋白质的二级结构发生了变化[10],这一结果与红外曲线拟合结果一致。
4 结论
本文利用圆二色光谱、傅立叶红外光谱研究了超低频脉冲电磁场作用后牛血清白蛋白的构象变化。傅立叶红外光谱显示牛血清白蛋白酰胺Ⅰ带和酰胺II带的的最大吸收峰都发生了红移,红外曲线拟合结果显示-螺旋含量降低,而-折叠和-转角含量升高。表明超低频脉冲电磁场作用后,使得BSA中氨基酸残基的微环境的二级结构发生了变化。圆二色光谱(CD)的数据显示-螺旋含量降低,表明超低频脉冲电磁场作用后BSA中氨基酸残基的微环境的二级结构改变。
